Ingrese una palabra o frase en cualquier idioma 👆
Idioma:
Traducción y análisis de palabras por inteligencia artificial
En esta página puede obtener un análisis detallado de una palabra o frase, producido utilizando la mejor tecnología de inteligencia artificial hasta la fecha:
- cómo se usa la palabra
- frecuencia de uso
- se utiliza con más frecuencia en el habla oral o escrita
- opciones de traducción
- ejemplos de uso (varias frases con traducción)
- etimología
Qué (quién) es Гидролиз - definición
ОБМЕННОЕ ВЗАИМОДЕЙСТВИЕ ВЕЩЕСТВА С ВОДОЙ, ПРИВОДЯЩЕЕ К РАЗЛОЖЕНИЮ И ОБРАЗОВАНИЮ НОВЫХ СОЕДИНЕНИЙ
Ферментативный гидролиз
ГИДРОЛИЗ
а, мн. нет, м., хим.
Реакция ионного обмена между различными веществами и водой. Гидролизный - относящийся к гид-ролизу.
ГИДРОЛИЗ
(от гидро ... и ...лиз), обменная реакция (обменное разложение) между веществом и водой, напр., AlCl3 + 3H2O ? Al(OH)3 + 3HCl. Основа многих технологических и природных процессов.
Гидролиз
(от Гидро... и греч. lýsis - разложение, распад)
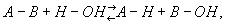
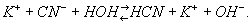
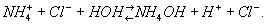
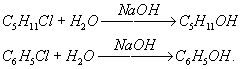
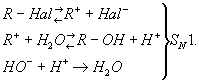
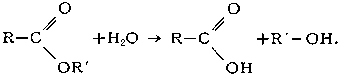
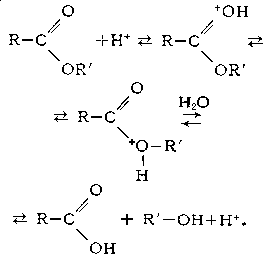
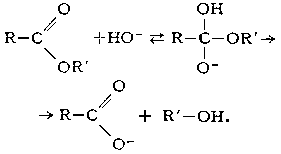
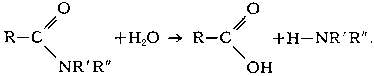
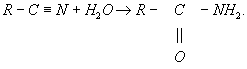
реакция ионного обмена между различными веществами и водой. В общем виде Г. можно представить уравнением:
где А-В - гидролизующееся вещество, А-Н и В-ОН - продукты Г.
Равновесие в процессе Г. солей подчиняется Действующих масс закону. Если в результате Г. образуется нерастворимое или легколетучее вещество, Г. идёт практически до полного разложения исходной соли. В остальных случаях Г. солей проходит тем полнее, чем слабее соответствующая соли кислота или основание.
Если Г. подвергается соль, образованная слабой кислотой и сильным основанием, например KCN, раствор имеет щелочную реакцию; это объясняется тем, что анион слабой кислоты частично связывает образовавшиеся при диссоциации воды ионы Н+ и в растворе остаётся избыток ионов OH-:
Раствор соли сильной кислоты и слабого основания, например NH4Cl, - кислый
Если заряд катиона (или аниона) соли больше единицы, то Г. часто приводит к образованию кислых (или основных) солей в качестве продуктов первой ступени процесса, например:
CuCl2 → Cu (OH) Cl → Cu (OH)2.
Количественной характеристикой Г. солей может служить степень гидролиза (α), определяемая отношением концентрации гидролизованной части молекул к общей концентрации данной соли в растворе; в большинстве случаев она невелика. Так, в 0,1 молярных растворах ацетата натрия CH3COONa или хлорида аммония NH4CI при 25 °С α = 0,01\%, а для ацетата аммония CH3COONH4 α = 0,5\%. С повышением температуры и разбавлением раствора степень Г. увеличивается.
Г. солей лежит в основе многих важных процессов в химической промышленности и лабораторной практике. Частичный Г. трёхкальциевого силиката является причиной выделения свободной извести при взаимодействии портландцемента с водой (см. Цемент). Благодаря Г. возможно существование буферных систем (См. Буферные системы), способных поддерживать постоянную кислотность среды. Такие растворы имеют и очень важное физиологическое значение - постоянная концентрация ионов Н+ необходима для нормальной жизнедеятельности организма. С Г. солей связан ряд геологических изменений земной коры и образование минералов, формирование природных вод и почв.
Гидролиз органических соединений - расщепление органического соединения водой с образованием двух или более веществ. Обычно Г. осуществляется в присутствии кислот (кислотный Г.) или щелочей (щелочной Г.). Гидролитическому расщеплению чаще всего подвергаются связи атома углерода с другими атомами (галогенами, кислородом, азотом и др.). Так, щелочной Г. галогенидов служит методом получения (в том числе и промышленного) спиртов и фенолов, например:
В зависимости от строения углеводородного радикала (R) и от условий реакции Г. галогенпроизводных может осуществляться как мономолекулярный (SN1) или бимолекулярный (SN2) процесс. В случае мономолекулярной реакции (См. Мономолекулярные реакции) вначале происходит ионизация связи углерод - галоген, а затем образующийся ион карбония реагирует с водой; щёлочь, если она добавлена, не влияет на скорость Г. и служит только для нейтрализации выделяющейся галогеноводородной кислоты и смещения равновесия:
В случае бимолекулярной реакции (См. Бимолекулярные реакции) скорость Г. прямо пропорциональна концентрации щёлочи:
R-Hal+ + HO- → R-OH + Hal-SN2.
Исключительно важен Г. сложных эфиров (реакция, обратная этерификации):
Кислотный Г. сложных эфиров является обратимым процессом:
Щелочной Г. сложных эфиров необратим, поскольку он приводит к образованию спирта и соли кислоты:
Этот процесс широко применяется в промышленности для получения спиртов и кислот, например при омылении жиров с целью получения глицерина и солей высших алифатических кислот (мыла).
Аналогично сложным эфирам гидролизуются амиды кислот:
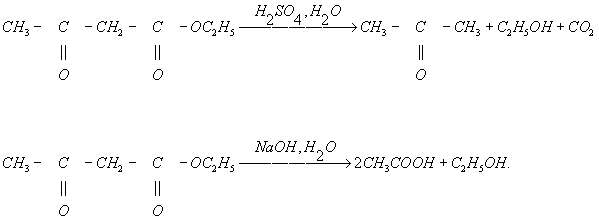
Случаи Г. углерод-углеродной связи сравнительно редки. К ним относятся, в частности, кетонное (действием кислот и разбавленных щелочей) и кислотное (действием концентрированной щёлочи) расщепление 1,3-дикарбонильных соединений, например ацетоуксусного эфира:
Термин "Г." обычно применяется в органической химии также по отношению к некоторым процессам, которые более правильно было бы называть гидратацией (См. Гидратация); примером может служить превращение нитрилов кислот в амиды:
Г. сложноэфирных, гликозидных (в углеводах) и амидных (в белках) связей играет огромную роль в жизнедеятельности любых организмов, например, в таких процессах, как усвоение пищи, передача нервных импульсов и т. п. Г. в живом организме катализируется ферментами гидролазами (См. Гидролазы). См. также Гидролиз растительных материалов.
Лит.: Киреев В. А., Курс физической химии, 2 изд., М., 1956; Реутов О. А., Теоретические проблемы органической химии, 2 изд., М., 1964.
Wikipedia
Гидролиз
Гидро́лиз (от др.-греч. ὕδωρ «вода» + λύσις «разложение») — химическая реакция взаимодействия вещества с водой, в результате которой происходит разложение этого вещества и воды с образованием новых соединений (сольволиз водой).
Ejemplos de uso de Гидролиз
1. Гидролиз производится при непрерывном перемешивании содержимого автоклава.
2. Гидролиз АТФ замечателен как раз высоким энергетическим выходом.
3. Но, познакомившись с химией, многие перешли на кислотный гидролиз - он несравненно дешевле, проще и быстрее.
4. В наших сопряженных реакциях (гидролиз АТФ и сборка полимера) условия стационарности и линейности выполнялись.
5. Гидролиз АТФ дает значительную энергию, которая обеспечивает стационарное состояние цепи необратимых реакций.

